
Remédios contra a Covid-19 ainda não foram incorporados ao SUS
Preço dos medicamentos é o principal entrave para a disponibilização na rede pública de saúde; veja quais tratamentos a Anvisa já aprovou
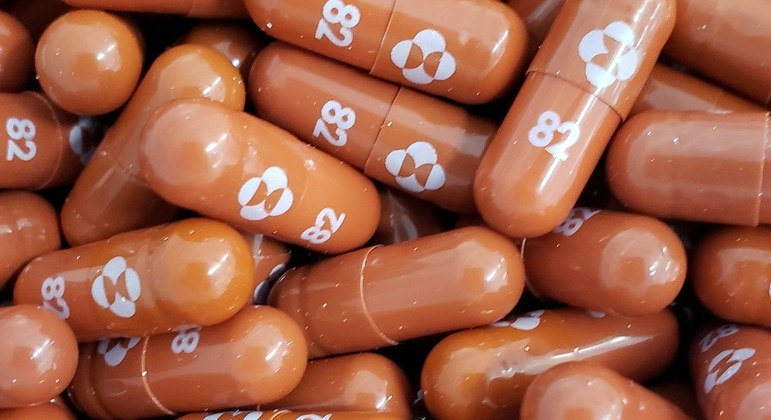
Dois anos após o início da pandemia, medicamentos com eficácia comprovada contra a Covid-19 não estão incorporados ao SUS (Sistema Único Saúde). Em hospitais privados, alguns remédios aprovados pela Anvisa (Agência Nacional de Vigilância Sanitária) para tratar a doença já são postos à disposição dos pacientes.
No caso das pílulas antivirais, como Molnupiravir e Paxlovid, ainda não houve aval para uso no Brasil. Aprovadas em outros países, elas podem fazer diferença quando ingeridas após os primeiros sintomas.
Como um dos principais entraves está no preço dos tratamentos, não há perspectiva de data para que esses remédios estejam disponíveis no SUS, uma vez que a Conitec (Comissão Nacional de Incorporação de Tecnologias) não recomendou a incorporação.
Remédios como Sotrovimabe e Evusheld não estão disponíveis para comercialização no país ou não têm cobertura para uso ambulatorial e domiciliar pela ANS (Agência Nacional de Saúde), que regula os planos de saúde.
A agência informou que os medicamentos desse tipo só têm cobertura obrigatória caso sejam prescritos pelo médico para administração durante a internação. Posteriormente, pode ser feita a solicitação de reembolso, mas, ainda assim, em alguns casos os pacientes acabam tendo de arcar com os medicamentos.
Esse, no entanto, não seria o cenário ideal, uma vez que tratamentos com remédios como o Remdesivir podem custar até R$ 20 mil, afirma a farmacologista e pesquisadora da Unifesp (Universidade Federal de São Paulo) Soraya Smaili.
"Quem mais sofreu óbitos com o pico da Ômicron foram pessoas acima de 80 anos. A vacina protege, mas a proteção pode ser reduzida em idosos e pessoas com comorbidades", diz. "Nessas condições, deveriam existir alternativas tanto no hospital quanto no ambulatório, o que poderia impedir quadros graves."
Os remédios para a Covid se dividem em duas frentes: a das pílulas antivirais de via oral, que podem ser efetivas quando administradas no início dos sintomas, e a dos anticorpos monoclonais, que simulam a proteção conferida pela vacina em diferentes estágios da infecção e correspondem à maioria dos remédios aprovados pela Anvisa.
Até o momento, apesar de o primeiro tipo já ter sido aprovado em países da Europa e nos Estados Unidos, somente o segundo tipo recebeu aval no Brasil. Ainda assim, nenhum foi recomendado pela Conitec para uso na rede pública.
Chefe do departamento de Infectologia da Unesp (Universidade Estadual Paulista), Alexandre Naime Barbosa explica que, para pacientes com Covid leve da rede privada, o Regdanvimabe seria o único com estoque disponível no Brasil. Produzido pela Celltrion Healthcare, ele seria capaz de reduzir o risco de progressão da Covid em 70%, segundo estudos clínicos de fase 3.
O preço, no entanto, é um entrave para a rede pública — vai de R$ 9.800 a R$ 12 mil, a depender do peso do paciente. Além disso, há uma hesitação em relação à eficácia dos anticorpos monoclonais no combate à Ômicron, mais transmissível, o que faz mesmo hospitais privados repensarem as estratégias para tratar a Covid.
No caso de pacientes com Covid-19 hospitalar, Naime Barbosa reforça, por outro lado, que a rede pública consegue oferecer opções como o corticosteroide Dexametasona, a primeira droga que se mostrou eficaz nesses casos. Outras alternativas, como ventilação e intubação, também foram incorporadas pelo SUS.
A Conitec analisa o Baracitinibe, inibidor seletivo da Eli Lilly usado para artrite reumatoide e que se mostrou eficaz contra a Covid. Na rede privada, tratamentos com o remédio custam entre R$ 2.000 e R$ 3.000, o que o tornaria mais acessível.
Em nota, o Ministério da Saúde reforçou que encerrou no último dia 24 o prazo para o envio de contribuições à consulta pública sobre a proposta de incorporação do remédio para tratamento da Covid. "Agora, o tema voltará para a Conitec para que os membros do plenário possam emitir a recomendação final", acrescentou. A pasta ressaltou que o Baricitinibe já tem registro no Brasil para o tratamento de artrite reumatoide e o uso para tratar a Covid foi aprovado pela Anvisa.
No Brasil, a Anvisa recebeu pedido de uso emergencial do Molnupiravir, da Merck Sharp & Dohme (MSD), em novembro. Conforme painel da agência, 53% da documentação teve a análise concluída, 41% estão em análise e 5% ainda estão pendentes de complementação. Em nota, a MSD informou que teve novas informações solicitadas pela agência há cerca de duas semanas e está compilando os dados.
No caso do Paxlovid, da Pfizer, o pedido foi feito em fevereiro. A Anvisa diz que 50% da documentação teve a análise concluída e 41% ainda estão em análise. A farmacêutica informou, em nota, aguardar a revisão da agência.
"O período para que o Paxlovid esteja disponível no Brasil dependerá da aprovação da Anvisa e também do andamento das negociações com o Ministério da Saúde para um possível acordo de compra", acrescentou.
 Afastamento Conheça as novas regras da licença-maternidade após internação
Afastamento Conheça as novas regras da licença-maternidade após internação  Inclusão Projetos que beneficiam pessoas com Transtorno do Espectro Autista passam na Câmara de Goiânia
Inclusão Projetos que beneficiam pessoas com Transtorno do Espectro Autista passam na Câmara de Goiânia  Boa Notícia Siamesas de Manaus recebem alta da UTI, em Goiânia
Boa Notícia Siamesas de Manaus recebem alta da UTI, em Goiânia  Saúde 7 alimentos que ajudam a dormir melhor (sem pesar na consciência!)
Saúde 7 alimentos que ajudam a dormir melhor (sem pesar na consciência!)  Saúde 'Devemos nos preparar para um ano difícil no combate à dengue no Brasil', afirma médica
Saúde 'Devemos nos preparar para um ano difícil no combate à dengue no Brasil', afirma médica  Saúde CIA considera ser mais “provável” que Covid-19 tenha vindo de laboratório na China
Saúde CIA considera ser mais “provável” que Covid-19 tenha vindo de laboratório na China 
Mín. 20° Máx. 28°
Mín. 20° Máx. 26°
ChuvaMín. 20° Máx. 27°
Chuva







